仅需100纳摩尔(nM)的极低浓度,一种被命名为"RNA导弹"的创新小分子药物就能精准破坏癌细胞的永生机制。实验数据显示,该药物可使ALT癌症标志物(APB小体)数量锐减50%,为骨肉瘤、脑瘤等难治性癌症开辟全新治疗路径。这项突破性成果由耶路撒冷希伯来大学医学院Raphael I. Benhamou博士团队完成,2025年10月6日发表于国际权威期刊《Advanced Science》。
传统认知中,癌细胞通过激活端粒酶维持端粒长度实现永生。但最新研究揭示,在骨肉瘤、胶质母细胞瘤等恶性程度最高的癌症中,癌细胞采用更原始的生存策略——端粒替代性延长(ALT)机制。这种机制不依赖端粒酶,而是通过重组染色体末端实现端粒延长。
科学家发现,ALT癌细胞中存在异常高水平的TERRA RNA分子。这种分子如同"幽灵指挥官",在端粒区域形成G-四链体(G4)结构,指挥染色体末端重组。正常细胞每分裂一次端粒就会缩短,而ALT癌细胞通过这种"偷窃"机制,持续获取其他染色体的端粒片段维持自身永生。
传统抗癌药物主要针对蛋白质靶点,但RNA分子因其复杂的三维折叠结构(尤其是G4结构)长期被视为"不可成药"目标。TERRA的G4结构就像一团乱麻,既没有蛋白质的明确结合口袋,又与细胞内数千种RNA存在结构相似性,开发特异性药物堪称天方夜谭。
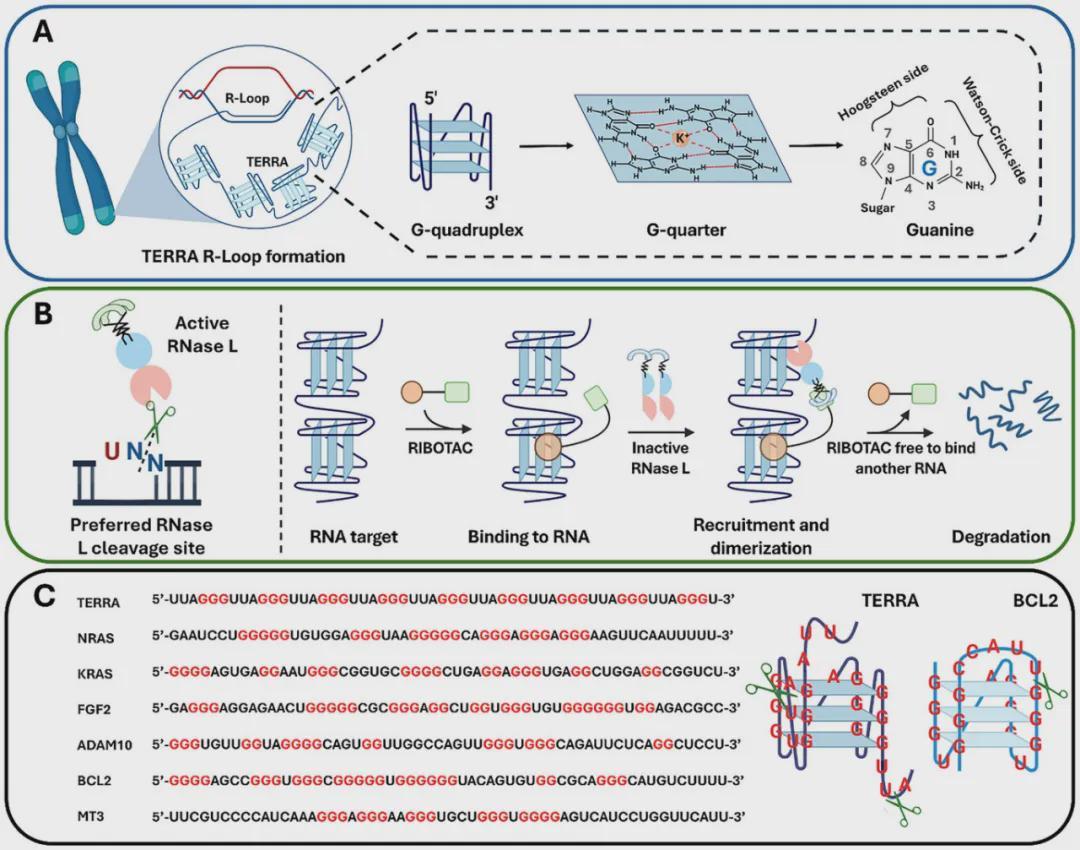
以色列团队开发的RIBOTAC(核糖核酸酶靶向嵌合体)技术,创造性地解决了这一难题。其核心药物RIBO-ISCH-1如同微型机器人,具备双重功能结构:
当双钳同时锁定目标时,RNase L被激活并特异性切割TERRA分子。实验显示,该药物在48小时内即可引发TERRA的雪崩式降解,且对其他G4结构RNA(如KRAS、BCL2)及基因组DNA完全无影响。
在U2OS骨肉瘤细胞模型中,RIBO-ISCH-1使ALT标志物APB小体数量下降50%,21天集落形成实验显示癌细胞增殖能力显著抑制。更关键的是,药物在100 nM浓度下即展现强效,且未观察到脱靶毒性或DNA损伤。

这项研究首次证明,小分子药物可精准降解特定长链非编码RNA(lncRNA),为癌症治疗开辟RNA调控新赛道。Benhamou博士指出:"我们不再局限于蛋白质靶点,而是学会了如何控制它们的上游调控者RNA。这可能为阿尔茨海默病、渐冻症等RNA相关疾病提供全新治疗策略。"
随着CRISPR-Cas13等RNA编辑技术的突破,RNA靶向疗法正成为生物医药领域最前沿的竞争高地。RIBO-ISCH-1的诞生,标志着人类在攻克癌症的征程中,又撕开了一道关键防线。
参考文献:
Khaskia, E., Dahatonde, D. and Benhamou, R.I. (2025). RNA G-Quadruplex RIBOTAC-Mediated Targeted Degradation of lncRNA TERRA. Advanced Science, 202512715. DOI: 10.1002/advs.202512715
