它精准“剪断”了癌症的生长信号,却“放过”了所有健康细胞!这或许标志着癌症治疗进入“既要疗效,又要生活质量”的精准医疗新纪元。近日,国际权威期刊《科学》(Science)杂志刊登了一项突破性研究:弗朗西斯·克里克研究所(The Francis Crick Institute)与Vividion Therapeutics的科研团队联合宣布,发现一种革命性化合物,可通过全新机制阻断肿瘤生长,同时完美规避传统疗法“杀敌一千,自损八百”的严重副作用。目前,相关药物已正式进入首次人体临床试验阶段。

故事要从癌症的“元凶”之一——RAS基因说起。尽管公众对其知之甚少,但约五分之一的癌症都与RAS突变密切相关。在正常细胞中,RAS如同“信号兵”,仅在需要时传递生长指令;而一旦突变,它便化身24小时不间断的“咆哮帝”,持续发出“生长!生长!生长!”的指令,导致细胞失控增殖,最终形成肿瘤。
科学家们提出一个简单逻辑:若想遏制肿瘤,需让RAS“沉默”。然而,RAS基因极其狡猾,直接靶向其活性极为困难。于是,研究团队将目光转向其“下游核心信使”——PI3Kα蛋白。
第一代药物(如Alpelisib)的策略是直接关闭PI3Kα的“发动机”(激酶活性),试图阻断所有来自RAS的信号。这一方法虽有效抑制肿瘤,却引发严重副作用:PI3Kα不仅响应RAS的“黑信号”,还承担着调控血糖的“白功能”。关闭其活性后,患者出现高血糖、皮疹等问题,生活质量急剧下降,治疗被迫中断。
“这就是癌症治疗的经典悖论:治疗靶点与正常功能高度重叠,如同在天使与魔鬼间走钢丝。”研究团队指出。
突破口出现在对PI3Kα蛋白结构的深入解析中。研究团队利用化学蛋白质组学平台,从数万个靶点中筛选出一类全新小分子化合物,其设计堪称“鬼斧神工”:
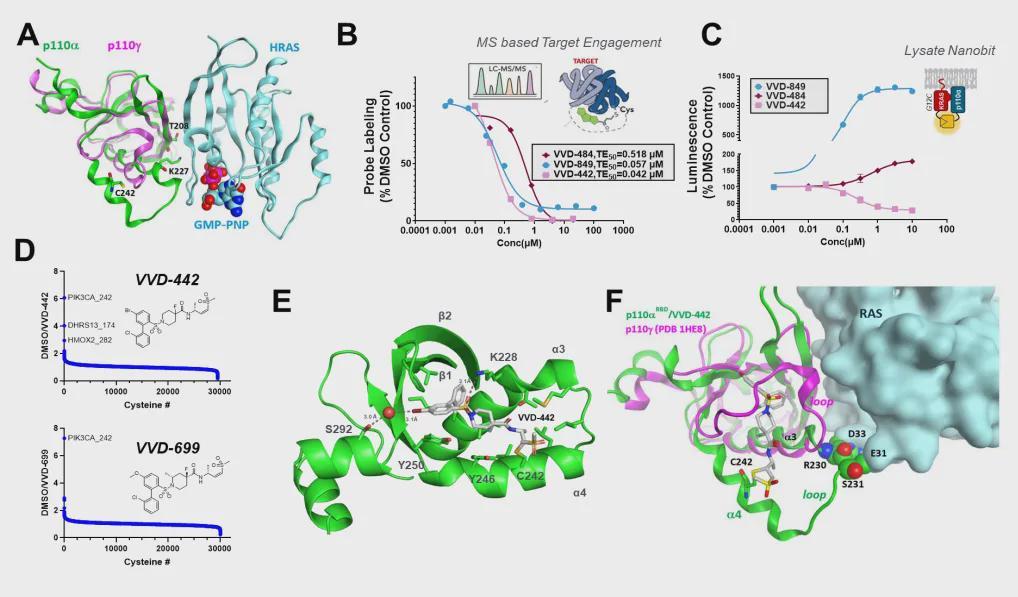
这一设计实现了真正的“外科手术式打击”:RAS的“黑电话线”被剪断,但PI3Kα的“发动机”完好无损。当胰岛素的“白电话线”打来时,PI3Kα仍能正常响应,维持血糖调控功能。
小鼠实验数据证实了新化合物的双重优势:
更令人惊喜的是,当研究团队将新药用于HER2过表达(一种常见乳腺癌驱动基因)的肿瘤时,发现其同样有效,且效果更强。进一步研究揭示,新药不仅阻断了RAS通路,还意外切断了HER2的另一条关键信号通路,实现了“一把钥匙开两把锁”的突破。
此外,当新药与KRASG12C抑制剂(如Adagrasib)联用时,在凶险的肺癌原位模型中实现了100%的完全、持久肿瘤消退,为联合疗法开辟了新方向。
目前,基于该机制的相关药物已获批进入首次人体临床试验,将重点测试其在RAS突变和HER2突变患者中的安全性与疗效。该研究的通讯作者之一、克里克研究所的朱利安·唐沃德(Julian Downward)教授表示:“我们专门针对PI3K和RAS的相互作用设计疗法,克服了传统治疗的局限性。看到临床试验启动,真的令人无比兴奋。”