红星资本局9月21日消息,在GLP-1/GIP双靶点新药研发竞争白热化的背景下,知名CRO企业美迪西(688202.SH)旗下全资子公司美迪西普亚医药科技(上海)有限公司(以下简称“美迪西普亚”)因安评报告交付严重滞后,遭客户鸿绪生物医药科技(北京)有限公司(以下简称“鸿绪生物”)起诉索赔1.59亿元,目前法院已对美迪西普亚采取财产保全措施。
据鸿绪生物发布的《关于依法对美迪西提起诉讼的声明》披露,美迪西普亚未按合同约定时间提供中英文版安评研究报告,导致其国内临床批件申请延误,美国临床申请亦遭失败。目前该案已进入司法程序,但尚未开庭审理。

资料图 图据视觉中国
根据美迪西9月5日公告,此次纠纷源于2020年12月签订的技术服务合同。鸿绪生物委托美迪西普亚对其I类生物技术药(多肽)开展非临床安全性评价研究,项目需同时满足中国NMPA和美国FDA的I期临床试验申报要求。合同明确规定,美迪西普亚应在8个月内完成分析检测、安全性评价、翻译及SEND转化四项试验,并提交中英文版试验报告。
然而鸿绪生物在声明中指出,美迪西普亚直至2022年12月底才交付中文盖章纸质报告,较合同约定时间滞后逾16个月。更严重的是,该报告未通过NMPA药品审评中心审查,迫使鸿绪生物另行委托第三方CRO公司补充试验后才获得临床试验批件(IND)。英文版报告同样存在交付滞后且未通过FDA审查的问题。
“首次使用美迪西安评报告申报国内IND被退审,第二次依据第三方补充报告才通过。美国申请则直接失败。”鸿绪生物强调,美迪西普亚的履约行为既未达到合同标准,也违背行业规范,导致项目和公司遭受重大损失。据此,鸿绪生物要求解除合同并索赔1.59亿元,而原始合同金额仅为557.6万元,其中尚有55.76万元尾款未支付。
涉诉项目“HX-100101-1注射液”系GLP-1/GIP双靶点药物,拟用于2型糖尿病治疗,已于2023年12月14日获批开展临床试验。该靶点组合因同时作用于GLP-1和GIP受体,在减重和降糖领域展现显著优势,目前全球仅礼来替尔泊肽获批减重适应症,恒瑞医药HRS9531注射液则成为国内首个提交上市申请的原研GLP-1/GIP双靶点激动剂。
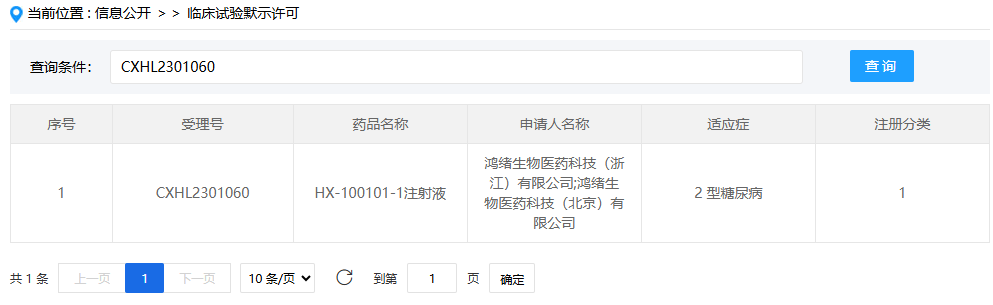
截图自国家药品监督管理局药品审评中心官网
作为专业临床前CRO企业,美迪西业务覆盖药物发现、药学研究及临床前研究全链条,曾获评“上海市科技小巨人企业”。针对此次诉讼,美迪西公告称不认可鸿绪生物主张,强调已按合同完成义务,项目已于2023年12月获得IND批件,且研发质量体系获全球主要药监部门认可。2025年3-4月,NMPA对该项目进行有因检查时未发现真实性问题。
美迪西表示,诉讼未对公司日常经营产生实质影响,已委托专业律师团队积极应诉。财报显示,美迪西普亚作为8家全资子公司中的核心企业,2024年贡献营收4.34亿元,占集团比重41.81%,但净亏损达7763.01万元。集团整体自2022年业绩高峰后持续下滑,2023、2024年分别净亏损3321万元和3.31亿元。
2025年半年报显示,美迪西上半年实现营收约5.4亿元,同比增长3.64%;归母净利润亏损约1290万元,较上年同期收窄超5700万元。成本管控成效显著,同期美迪西普亚实现营收约2.13亿元,净利润625.3万元。
红星新闻记者 蒋紫雯
编辑 余冬梅
